
Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
LM11A-31-lääke hidastaa Alzheimerin taudin etenemistä tutkimuksessa
Viimeksi tarkistettu: 02.07.2025

Nature Medicine -lehdessä julkaistussa äskettäisessä tutkimuksessa tutkijat suorittivat satunnaistetun, kaksoissokkoutetun, lumekontrolloidun vaiheen 2a tutkimuksen, jossa selvitettiin LM11A-31:n turvallisuutta ja tehoa Alzheimerin taudin (AD) hoidossa p75-neurotrofiinireseptorin (p75NTR) moduloinnin kautta.
Myöhäisvaiheessa alkava Alzheimerin tauti on yleisin dementian muoto, jolle on ominaista synaptisten toimintojen vajaatoiminta, rappeutuminen ja hermosolujen menetys. Vaikka kaksi johtavaa Alzheimerin taudin hoitoon tarkoitettua lääkettä kohdistuvat epänormaalien amyloid-β- eli tau-proteiinien kertymiseen, ne vaikuttavat vain osaan patofysiologiasta. Toinen lähestymistapa sisältää kohdistamisen reseptoreihin ja signaaliverkostoihin, jotka vaikuttavat perustavanlaatuisiin biologisiin reitteihin. Prekliiniset tutkimukset osoittavat, että p75NTR:n modulointi uudella pienellä kemiallisella molekyylillä, LM11A-31, vähentää amyloidin ja epänormaalin taun aiheuttamaa synaptista hävikkiä.
Tutkimuksen kuvaus
Tässä satunnaistetussa kliinisessä tutkimuksessa tutkijat selvittivät, voisiko LM11A-31 hidastaa Alzheimerin taudin etenemistä moduloimalla p75NTR:ää ihmisillä.
Tutkimukseen osallistujille annettiin LM11A-31-kapseleita suun kautta 200 mg:n ja 400 mg:n annoksina tai lumelääkettä suhteessa 1:1:1 242 lievää tai kohtalaista astmaa sairastavalle potilaalle 26 viikon ajan. Osallistujilla oli biologisesti varmistettu Alzheimerin tauti (aivo-selkäydinnesteen amyloid β -proteiini 42:n (Aβ42) taso alle 550 ng/l tai Aβ42:β40-suhde alle 0,89), joka oli diagnosoitu McKhannin kriteerien mukaisesti. Mini-psykiatrisen tutkimuksen (MMSE) pisteet olivat 18–26, geriatrisen masennusasteikon (GDS) pisteet alle 5,0, muokatun Hachinskin iskemia-asteikon (HIS) pisteet ≤ 4,0, muodollinen koulutus ≥ 8 vuotta ja aiempi kognitiivinen heikkeneminen ≥ 6 kuukautta.
Tutkimukseen osallistujat olivat käyttäneet asetyylikoliesteraasin estäjiä (AChEI) tai osittaisia NMDA-reseptorin antagonisteja vähintään 3 kuukauden ajan ennen tutkimukseen osallistumista. He eivät käyttäneet laittomia huumeita, kuten antipsykootteja, bentsodiatsepiineja, epilepsialääkkeitä, rauhoittavia lääkkeitä, keskushermostossa vaikuttavia verenpainelääkkeitä, nootrooppisia lääkkeitä (paitsi ginkgo biloba) tai opioideja sisältäviä kipulääkkeitä.
Tutkimuksen ensisijainen tulos oli turvallisuus ja siedettävyys, joita arvioitiin Columbian itsemurha-ajatusten ja käyttäytymisen vakavuusasteikkoa (C-SSRS) käyttäen, sekä elintoimintojen, verenpaineen ja hematologisten parametrien perusteella. Rakenteellista magneettikuvausta (cMRI), fluorodeoksiglukoosi-positroniemissiotomografiaa (FDG-PET) ja aivo-selkäydinnesteen (CSF) biomarkkereita käytettiin toissijaisten kognitiivisten tulosten arviointiin. Alzheimerin taudin mittareihin kuuluivat Thr181-fosforyloitu tau, taun kokonaisproteiini, Aβ40, Aβ42 ja AChE-aktiivisuus. Tiimi käytti räätälöityä neuropsykologista testiä toissijaisten kognitiivisten tulosten arvioimiseen lähtötilanteessa, viikoilla 12 ja 26.
Tutkimustulokset
Tutkimuksessa todettiin, että LM11A-31 on turvallinen ja hyvin siedetty, eikä merkittäviä turvallisuusongelmia ilmennyt. Yleisimpiä haittatapahtumia olivat päänsärky, ripuli, eosinofilia ja nenänielun tulehdus, ja ruoansulatuskanavan ongelmat ja eosinofilia olivat tärkeimmät lopettamisen syyt. 400 mg:n ryhmässä oli enemmän lopettamisia verrattuna 200 mg:n ja lumelääkeryhmiin. Magneettikuvauksessa ei havaittu turvallisuusongelmia, mukaan lukien amyloidiin liittyviä poikkeavuuksia. Kognitiivisissa pisteissä tai amyloidipoikkeavuuksissa ei ollut merkittäviä eroja kahden hoitoryhmän välillä.
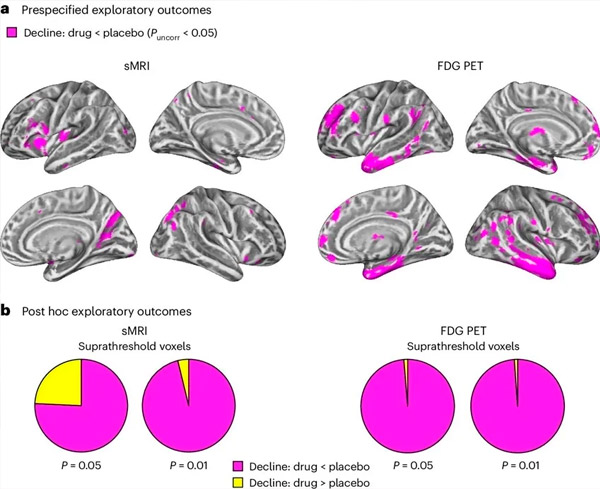
A. Kaksisuuntainen sekamallianalyysi kovarianssista tutki hoidon (lääke tai lumelääke) ja ajan (ennen hoitoa tai sen jälkeen) välisiä vuorovaikutuksia. Yksisuuntainen t-kontrasti, jossa tarkasteltiin vuorovaikutushypoteesia (lääke hidastaa etenemistä lumelääkkeeseen verrattuna), osoitti, että LM11A-31-hoito hidasti pitkittäistä rappeutumista (vasen paneeli) ja glukoosihypometabolismia (oikea paneeli) lääkeryhmässä (cMRI, n = 127; PET, n = 121) verrattuna lumelääkeryhmään (cMRI, n = 66; PET, n = 62). Tätä vuorovaikutusta osoittavat vokselit on esitetty korjaamattomalla kynnysarvolla P < 0,05 (magenta) populaatiokohtaisella aivokuoren pinnalla. Vasen ja oikea aivopuolisko on esitetty vastaavasti ylä- ja alarivillä. Aivoalueet, jotka osoittavat hypoteesin kanssa ristiriidassa olevia vuorovaikutuksia, on esitetty lisätietojen kuvassa 7.
B. Vokselien kokonaismäärä ennalta määritellyillä haavoittuvilla Alzheimerin taudin aivoalueilla (ympyräkaavioiden kokonaispinta-ala), jotka osoittavat joko hypoteesin mukaista vuorovaikutusta (magenta) tai hypoteesin kanssa ristiriitaista vuorovaikutusta (keltainen) kussakin kuvantamismenetelmässä (cMRI, vasen paneeli; FDG PET, oikea paneeli) yhä liberaaleilla korjaamattomilla kynnysarvoilla P < 0,01 ja P < 0,05. Monte Carlo -simulaatiot osoittivat, että hypoteesin mukaista ja hypoteesin kanssa ristiriitaista vaikutusta osoittavien vokselien suhdeluvut olivat merkittävästi korkeammat kuin sekä cMRI:n että PET:n satunnaisesti luodun datan perusteella havaitut (P < 0,001 kummassakin menetelmässä; kaksisuuntainen testi).
LM11A-31 vähensi tehokkaasti aivo-selkäydinnesteen Aβ42- ja Aβ40-pitoisuuksien nousua lumelääkeryhmään verrattuna. Lääke vähensi myös presynaptisen proteiinibiomarkkeri SNAP25:n mediaanivuottaista prosentuaalista muutosta ja postsynaptisen biomarkkeri NG:n laskua, mikä viittaa presynaptisten ja postsynaptisten yhteyksien menetyksen hidastumiseen. LM11A-31 vähensi myös YKL40:n nousua, mikä johti MMSE-pisteiden laskuun ja ADAS-Cog-13-pisteiden nousuun. Lääke vähensi myös harmaan aineen hävikkiä otsalohkossa ja takaosan päälaen kuoressa sekä glukoosiaineenvaihdunnan vähenemistä esimerkiksi entorinaalilohkossa, ohimolohkossa, hippokampuksessa, saarekkeen kuoressa ja prefrontaalisessa kuoressa.
Johtopäätös
Tutkimuksessa pääteltiin, että p75NTR:n säätely LM11A-31:llä soveltuu suurempiin kliinisiin tutkimuksiin. LM11A-31 täytti ensisijaisen turvallisuuspäätetapahtuman ja oli hyvin siedetty lievää tai vaikeaa Alzheimerin tautia sairastavilla potilailla. Tulokset osoittavat, että tarvitaan lisätutkimuksia, joissa hoitojaksoja on pidempi, jotta voidaan arvioida pienten molekyylien potentiaalia säädellä p75NTR:ää taudin kulkua modifioivana hoitona Alzheimerin taudissa. Tutkimus osoitti, että LM11A-31 vaikutti merkittävästi useisiin biomarkkereihin, mukaan lukien Aβ40, Aβ42, SNAP25, NG ja YKL40, mikä viittaa patologisen etenemisen hidastumiseen. Tulevissa tutkimuksissa voidaan arvioida muita gliasolujen terveyden indikaattoreita.
