
Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Suljetun kierron lääkkeenjakelujärjestelmä voisi parantaa kemoterapian antoa
Viimeksi tarkistettu: 02.07.2025
Kun syöpäpotilaat saavat kemoterapiaa, useimpien lääkkeiden annokset lasketaan potilaan kehon pinta-alan perusteella. Tämä arvioidaan yhtälöllä, joka ottaa huomioon potilaan pituuden ja painon. Tämä yhtälö laadittiin vuonna 1916 vain yhdeksän potilaan tietojen perusteella.
Tämä yksinkertaistettu annostelutapa ei ota huomioon muita tekijöitä ja voi johtaa siihen, että potilaalle annetaan liikaa tai liian vähän lääkettä. Tämän seurauksena joillakin potilailla voi esiintyä tarpeetonta toksisuutta tai riittämätöntä tehoa saamastaan kemoterapiasta.
Kemoterapia-annostelun tarkkuuden parantamiseksi MIT:n insinöörit ovat kehittäneet vaihtoehtoisen lähestymistavan, jonka avulla annos voidaan yksilöidä kullekin potilaalle. Heidän järjestelmänsä mittaa lääkkeen määrän potilaan kehossa ja syöttää tiedot ohjaimeen, joka voi säätää infuusionopeutta vastaavasti.
Tutkijoiden mukaan tämä lähestymistapa voisi auttaa kompensoimaan lääkkeiden farmakokineettisiä eroja, jotka johtuvat kehon koostumuksesta, geneettisestä alttiudesta, kemoterapian aiheuttamasta elintoksisuudesta, yhteisvaikutuksista muiden lääkkeiden ja ruoan kanssa sekä kemoterapia-lääkkeiden hajottamisesta vastaavien entsyymien vuorokausirytmin vaihteluista.
"Tunnistamalla edistysaskeleet lääkkeiden metabolian ymmärtämisessä ja soveltamalla teknisiä työkaluja yksilöllisen annostelun yksinkertaistamiseksi uskomme voivamme auttaa muuttamaan monien lääkkeiden turvallisuutta ja tehokkuutta", sanoo Giovanni Traverso, MIT:n konetekniikan apulaisprofessori, Brigham and Women's Hospitalin gastroenterologi ja tutkimuksen vanhempi kirjoittaja.
MIT:n jatko-opiskelija Louis DeRidder on Med-lehdessä julkaistun artikkelin pääkirjoittaja.
Jatkuva seuranta
Tässä tutkimuksessa tutkijat keskittyivät 5-fluorourasiili -nimiseen lääkkeeseen, jota käytetään paksusuolen syövän ja muiden syöpien hoitoon. Lääke annetaan tyypillisesti 46 tunnin aikana, ja sen annostus määritetään potilaan pituuteen ja painoon perustuvalla kaavalla, joka antaa arvion kehon pinta-alasta.
Tämä lähestymistapa ei kuitenkaan ota huomioon kehon koostumuksen eroja, jotka voivat vaikuttaa lääkkeen jakautumiseen kehossa, tai geneettisiä variaatioita, jotka vaikuttavat sen metaboliaan. Nämä erot voivat johtaa haitallisiin sivuvaikutuksiin, jos lääkettä annetaan liikaa. Jos lääkettä ei anneta riittävästi, se ei välttämättä tappaa kasvainta odotetulla tavalla.
"Saman kehon pinta-alan omaavilla ihmisillä voi olla hyvin eri pituudet ja painot, erilainen lihasmassa tai erilainen genetiikka, mutta niin kauan kuin yhtälöön kytketty pituus ja paino antavat saman kehon pinta-alan, heidän säteilyannoksensa on identtinen", sanoo DeRidder, lääketieteellisen tekniikan ja lääketieteellisen fysiikan tohtorikoulutettava Harvard-MIT:n terveystieteiden ja -teknologian ohjelmassa.
Toinen tekijä, joka voi muuttaa lääkkeen määrää veressä millä tahansa hetkellä, on dihydropyrimidiinidehydrogenaasin (DPD) entsyymin vuorokausirytmin vaihtelu. DPD:n ilmentymistä, kuten monia muitakin kehon entsyymejä, säätelee vuorokausirytmi. Siten 5-FU:n hajoaminen DPD:n avulla ei ole vakio, vaan vaihtelee vuorokaudenajan mukaan. Nämä vuorokausirytmit voivat johtaa kymmenkertaiseen vaihteluun 5-FU:n määrässä potilaan veressä infuusion aikana.
”Käyttämällä kehon pinta-alaa kemoterapia-annoksen laskemiseen tiedämme, että kahdella ihmisellä voi olla hyvin erilaisia 5-fluorourasiilin aiheuttamia toksisia vaikutuksia. Yhdellä potilaalla voi olla hoitojaksoja, joissa toksisuus on minimaalinen, ja sitten jakso, jossa toksisuus on erittäin vakava. Jokin on muuttunut siinä, miten potilas metaboloi kemoterapiaa jaksosta toiseen. Vanhentunut annostusmenetelmämme ei ota huomioon näitä muutoksia, ja potilaat kärsivät niiden seurauksena”, sanoo Douglas Rubinson, kliininen onkologi Dana-Farber Cancer Institutesta ja yksi tämän artikkelin kirjoittajista.
Yksi tapa yrittää kompensoida kemoterapian farmakokinetiikan vaihtelua on strategia, jota kutsutaan terapeuttisen lääkkeen monitoroimiseksi. Siinä potilas antaa verinäytteen yhden hoitojakson lopussa. Kun tästä näytteestä on analysoitu lääkepitoisuudet, annostusta voidaan tarvittaessa säätää seuraavan hoitojakson alussa (yleensä kahden viikon kuluttua 5-fluorourasiilin tapauksessa).
Tämän lähestymistavan on osoitettu johtavan parempiin tuloksiin potilailla, mutta sitä ei ole käytetty laajalti kemoterapioissa, kuten 5-fluorourasiilissa.
MIT:n tutkijat halusivat kehittää samanlaisen seurantajärjestelmän, mutta automatisoidulla tavalla, joka mahdollistaisi lääkeannostelun personoinnin reaaliajassa, mikä voisi johtaa parempiin hoitotuloksiin potilaille.
Suljetun kierron järjestelmässä lääkepitoisuuksia voidaan seurata jatkuvasti, ja tätä tietoa käytetään kemoterapialääkkeen infuusionopeuden automaattiseen säätämiseen annoksen pitämiseksi tavoitealueella.
Tämä suljetun kierron järjestelmä mahdollistaa lääkeannostelun yksilöllisen räätälöinnin ottaen huomioon lääkeaineita metaboloivien entsyymien tasojen vuorokausirytmit sekä mahdolliset muutokset potilaan farmakokinetiikassa viimeisimmän hoitokerran jälkeen, kuten kemoterapian aiheuttama elintoksisuus.
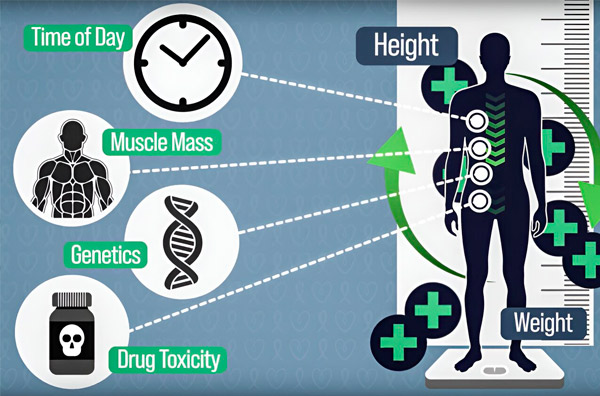
Jotta kemoterapia-annostusta voitaisiin tarkentaa, MIT:n insinöörit ovat kehittäneet tavan mitata jatkuvasti lääkkeen määrää potilaan kehossa usean tunnin infuusion aikana. Tämä auttaa kompensoimaan kehon koostumuksen, genetiikan, lääketoksisuuden ja vuorokausirytmin heilahtelujen aiheuttamia eroja. Lähde: Tutkijoiden luvalla.
Tutkijoiden kehittämä uusi järjestelmä, joka tunnetaan nimellä CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), käyttää kaupallisesti saatavilla olevia laitteita jokaisessa vaiheessa. Verinäytteitä otetaan viiden minuutin välein ja ne valmistellaan nopeasti analyysia varten. Veren 5-fluorourasiilin pitoisuus mitataan ja verrataan tavoitealueeseen.
Tavoite- ja mitattujen pitoisuuksien välinen ero syötetään ohjausalgoritmiin, joka sitten säätää infuusionopeutta tarpeen mukaan pitääkseen annoksen pitoisuusalueella, jolla lääke on tehokas ja myrkytön.
"Olemme kehittäneet järjestelmän, jossa voimme jatkuvasti mitata lääkepitoisuutta ja säätää infuusionopeutta vastaavasti pitääksemme lääkepitoisuuden terapeuttisessa ikkunassa", DeRidder sanoo.
Nopea säätö
Eläinkokeissa tutkijat havaitsivat, että CLAUDIAn avulla he pystyivät pitämään kehossa kiertävän lääkkeen määrän tavoitealueella noin 45 prosenttia ajasta.
Eläimillä, joille annettiin kemoterapiaa ilman CLAUDIAa, lääkepitoisuudet pysyivät tavoitealueella keskimäärin vain 13 prosentissa ajasta. Tutkijat eivät testanneet lääkepitoisuuksien tehokkuutta tässä tutkimuksessa, mutta pitoisuuksien ylläpitämisen tavoitealueella uskotaan johtavan parempiin tuloksiin ja vähäisempään toksisuuteen.
CLAUDIA pystyi myös pitämään 5-fluorourasiilin annoksen tavoitealueella, vaikka annettiin DPD-entsyymiä estävää lääkettä. Eläimillä, joille annettiin tätä estäjää ilman jatkuvaa seurantaa ja annoksen säätöä, 5-fluorourasiilin pitoisuudet nousivat jopa kahdeksankertaisiksi.
Tässä demonstraatiossa tutkijat suorittivat prosessin jokaisen vaiheen manuaalisesti valmiilla laitteilla, mutta nyt he aikovat automatisoida jokaisen vaiheen, jotta seuranta ja annosten säädöt voidaan tehdä ilman ihmisen puuttumista asiaan.
Lääkepitoisuuksien mittaamiseen tutkijat käyttivät korkean suorituskyvyn nestekromatografia-massaspektrometriaa (HPLC-MS), tekniikkaa, jota voidaan soveltaa lähes minkä tahansa tyyppisen lääkkeen havaitsemiseen.
"Näemme tulevaisuudessa, jossa voimme käyttää CLAUDIAa minkä tahansa lääkkeen kanssa, jolla on asianmukaiset farmakokineettiset ominaisuudet ja joka on havaittavissa HPLC-MS:llä, mikä mahdollistaa monien eri lääkkeiden yksilöllisen annostelun", DeRidder sanoo.
