
Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Ihmisen immuunikatovirus (HIV)
Lääketieteen asiantuntija
Viimeksi tarkistettu: 04.07.2025
Hankittu immuunikato-oireyhtymä tunnistettiin omaksi sairaudekseen vuonna 1981 Yhdysvalloissa, kun useat nuoret sairastuivat vakaviin sairauksiin, jotka aiheutuivat terveille ihmisille ei-patogeenisistä tai heikosti patogeenisista mikro-organismeista. Potilaiden immuunijärjestelmän tutkimuksessa havaittiin lymfosyyttien määrän jyrkkä lasku yleisesti ja erityisesti T-auttajasolujen määrän lasku. Tätä tilaa kutsuttiin AIDSiksi (Acquired Immune Deficiency Syndrome). Tartuntatapa (seksuaalinen kontakti, veren ja sen valmisteiden välityksellä) osoitti taudin tarttuvan luonteen.
AIDSin aiheuttajan löysivät itsenäisesti vuonna 1983 ranskalainen L. Montagnier, joka nimesi viruksen LAV-lymfoadenopatian assosioituneeksi virukseksi, koska hän löysi sen lymfadenopatiaa sairastavalta potilaalta; ja amerikkalainen R. Gallo, joka nimesi viruksen HTLV-III:ksi (ihmisen T-lymfotrooppinen virus III): hän oli aiemmin löytänyt lymfotrooppiset virukset I ja II.
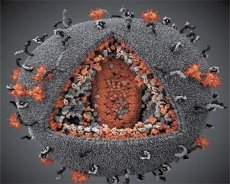
LAV- ja HTLV-III-virusten ominaisuuksien vertailu osoitti niiden identtisyyden, joten sekaannuksen välttämiseksi virus nimettiin vuonna 1986 HIV:ksi (Human Immunodeficiency Virus eli HIV). HIV on muodoltaan pallomainen, halkaisijaltaan 110 nm. Viruksen vaippa on monihalkaisijan muotoinen ja koostuu 12 viisikulmiosta ja 20 kuusikulmiosta. Kunkin kuusikulmion keskellä ja kulmissa on glykosyloituneen proteiinin gpl20 molekyyli (luku 120 osoittaa proteiinin molekyylipainon kilodaltoneina). Virionin pinnalla sijaitsee yhteensä 72 gpl20-molekyyliä erikoisten piikkien muodossa, joista jokainen liittyy kalvon sisäiseen proteiiniin gp41. Nämä proteiinit muodostavat yhdessä kaksoislipidikerroksen kanssa virionin superkapsidin (kalvon).
Gpl20- ja gp41-proteiinit muodostuvat, kun solun proteaasi katkaisee Env-esiasteproteiinin. gp41-proteiini muodostaa piikki"varren" sitoutumalla sytoplasmisella domeenillaan matriisiproteiiniin p17MA, joka sijaitsee suoraan vaipan alla. p17-molekyylit vuorovaikuttavat virionin kypsymisen aikana muodostaen ikosaedrin vaipan alle.
Virionin keskiosassa p24-proteiini muodostaa kartiomaisen kapsidin. Kapsidin kaventunut osa on yhteydessä virionikalvoon rb-proteiinin osallistuessa. Kapsidin sisällä on kaksi identtistä viruksen genomista RNA:ta. Ne ovat 5'-päistään yhteydessä nukleokapsidiproteiiniin p7NC. Tämä proteiini on mielenkiintoinen, koska siinä on kaksi kysteiini- ja histidiinirikasta aminohappotähtettä (motiivia), jotka sisältävät Zn-atomin. Niitä kutsutaan "sinkkisormiksi", koska ne vangitsevat genomisen RNA:n molekyylejä sisällytettäväksi muodostuviin virioneihin. Kapsidi sisältää myös kolme entsyymiä. Revertaasi (RT) eli pol-kompleksi sisältää käänteiskopioijaentsyymin, RNaasi H:n ja DNA-riippuvaisen DNA-polymeraasin. Revertaasi esiintyy heterodimeerinä p66/p51. Proteaasi (PR) - p10 käynnistää ja toteuttaa virionin kypsymisprosessin. Integraasi (IN) - p31 eli endonukleaasi varmistaa proviraalisen DNA:n sisällyttämisen isäntäsolun genomiin. Kapsidi sisältää myös primer-RNA-molekyylin (tRNAl"3).
Solun RNA-genomi muunnetaan käänteiskopioijaentsyymin avulla DNA-genomiksi (DNA-provirukseksi), joka koostuu 9283 nukleotidiparista. Sitä rajoittavat vasemmalta ja oikealta niin sanotut pitkät terminaalitoistot eli LTR:t: S'-LTR vasemmalla ja 3'-LTR oikealla. LTR:t sisältävät kukin 638 nukleotidiparia.
HIV-genomi koostuu yhdeksästä geenistä, joista osa on päällekkäisiä päistään (niillä on useita lukukehyksiä) ja niillä on eksonintronirakenne. Ne säätelevät yhdeksän rakenneproteiinin ja kuuden säätelyproteiinin synteesiä.
LTR:ien merkitys virusgenomille on se, että ne sisältävät seuraavat säätelyelementit, jotka säätelevät sen toimintaa:
- transkriptiosignaali (promoottorialue);
- poly-A-additiosignaali;
- rajaussignaali;
- integrointisignaali;
- positiivinen säätelysignaali (TAR TAT-proteiinille);
- negatiivinen säätelyelementti (NRE NEF-proteiinille);
- 3'-päässä oleva kohta aluke-RNA:n (tRNA™3) kiinnittymiseen miinus-juoste-DNA:n synteesiä varten; LTR:n 5'-päässä oleva signaali, joka toimii alukkeena plus-juoste-DNA:n synteesiä varten.
Lisäksi LTR sisältää elementtejä, jotka osallistuvat mRNA:n silmukoinnin säätelyyn ja vRNA-molekyylien pakkaamiseen kapsidiin (Psi-elementti). Lopuksi genomin transkription aikana pitkissä mRNA:issa muodostuu kaksi signaalia REV-proteiinille, jotka vaihtavat proteiinisynteesiä: CAR - säätelyproteiineille ja CRS - rakenneproteiineille. Jos REV-proteiini sitoutuu CAR:iin, syntetisoidaan rakenneproteiineja; jos sitä ei ole, syntetisoidaan vain säätelyproteiineja.
Seuraavilla säätelygeeneillä ja niiden proteiineilla on erityisen tärkeä rooli virusgenomin toiminnan säätelyssä:
- TAT-proteiini, joka suorittaa viruksen replikaation positiivisen kontrollin ja toimii TAR-säätelyalueen kautta;
- NEV- ja VPU-proteiinit, jotka kohdistavat replikaation negatiivista kontrollia NRE-alueen kautta;
- REV-proteiini, joka suorittaa positiivis-negatiivista kontrollia. REV-proteiini kontrolloi gag-, pol- ja env-geenien toimintaa ja suorittaa silmukoinnin negatiivista säätelyä.
Siten HIV-replikaatio on kolminkertaisen kontrollin alaisena - positiivinen, negatiivinen ja positiivis-negatiivinen.
VIF-proteiini määrittää vasta syntetisoidun viruksen infektiivisyyden. Se liittyy p24-kapsidiproteiiniin ja sitä on virionissa 60 molekyylin määränä. NEF-proteiinia esiintyy virionissa pienenä määränä molekyylejä (5–10), jotka mahdollisesti liittyvät viruksen vaippaan.
VPR-proteiini estää solusyklin G2-vaiheessa, osallistuu preintegraatiokompleksien kuljetukseen solun tumaan, aktivoi joitakin virus- ja solugeenejä ja tehostaa virusten replikaatiota monosyyteissä ja makrofageissa. VPR-, TAT-, REV- ja VPU-proteiinien sijaintia virionissa ei ole vahvistettu.
Omien proteiinien lisäksi virionin kalvo voi sisältää joitakin isäntäsolun proteiineja. VPU- ja VPR-proteiinit osallistuvat viruksen lisääntymisen säätelyyn.
Ihmisen immuunikatoviruksen (HIV) antigeeniset variantit
Ihmisen immuunikatovirus (HIV) on hyvin vaihteleva. Jopa yhden potilaan kehosta voidaan eristää viruskantoja, jotka eroavat merkittävästi antigeenisten ominaisuuksien suhteen. Tätä vaihtelua helpottaa CD4+-solujen voimakas tuhoutuminen ja voimakas vasta-ainevaste HIV-infektiolle. Länsi-Afrikasta kotoisin olevilta potilailta on eristetty uusi HIV-muoto, HIV-2, joka on biologisesti lähellä HIV-1:tä, mutta immunologisesti erilainen. Näiden virusten genomien primaarirakenteen homologia on 42 %. HIV-2:n DNA-provirus sisältää 9671 emäsparia ja sen LTR-sekvenssin 854 emäsparia. HIV-2:ta on myöhemmin eristetty muualta maailmasta. HIV-1:n ja HIV-2:n välillä ei ole ristiimmuniteettia. HIV-1:stä tunnetaan kaksi suurta muotoa: O (Outlier) ja M (Major), jälkimmäinen jaetaan 10 alatyyppiin (AJ). Venäjällä liikkuu kahdeksan alatyyppiä (AH).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
HIV:n ja solun vuorovaikutusmekanismi
Kehoon tunkeuduttuaan virus hyökkää ensin soluihin, jotka sisältävät sille spesifisen CD4-reseptorin. Tätä reseptoria on suuria määriä T-auttajasoluissa, pienempiä määriä makrofageissa ja monosyyteissä, ja T-auttajasolut ovat erityisen herkkiä virukselle.
Ihmisen immuunikatovirus (HIV) tunnistaa CD4-reseptorit gpl20-proteiininsa avulla. HIV:n vuorovaikutus solun kanssa tapahtuu seuraavan kaavan mukaisesti: reseptorivälitteinen adsorptio -> päällystetty kuoppa -> päällystetty vesikkeli -> lysosomi. Tässä kaavassa virionikalvo fuusioituu lysosomikalvon kanssa, ja superkapsidista vapautunut nukleokapsidi pääsee sytoplasmaan; matkalla tumaan se tuhoutuu ja genominen RNA ja siihen liittyvät ydinkomponentit vapautuvat. Sitten käänteiskopioijaentsyymi syntetisoi virionin RNA:n DNA:n miinusjuosteen, sitten RNase H tuhoaa virionin RNA:n ja viruksen DNA-polymeraasi syntetisoi DNA:n plusjuosteen. DNA-proviruksen päihin muodostuu 5'-LTR ja 3'-LTR. DNA-provirus voi pysyä tumassa jonkin aikaa inaktiivisessa muodossa, mutta ennemmin tai myöhemmin se integroituu kohdesolun kromosomiin integraasinsa avulla. Siinä provirus pysyy inaktiivisena, kunnes mikrobien antigeenit tai muut immunokompetentit solut aktivoivat kyseisen T-lymfosyytin. Solujen DNA-transkription aktivaatiota säätelee erityinen tumatekijä (NF-kB). Se on DNA:han sitoutuva proteiini, jota tuotetaan suuria määriä T-lymfosyyttien ja monosyyttien aktivaation ja lisääntymisen aikana. Tämä proteiini sitoutuu tiettyihin solujen DNA-sekvensseihin ja DNA-proviruksen vastaaviin LTR-sekvensseihin ja indusoi sekä solujen DNA:n että DNA-proviruksen transkriptiota. Indusoimalla DNA-proviruksen transkriptiota se siirtää viruksen inaktiivisesta tilasta aktiiviseen ja vastaavasti pysyvästä infektiosta tuottavaan tilaan. Provirus voi pysyä inaktiivisessa tilassa hyvin pitkään. Viruksen aktivointi on kriittinen hetki sen vuorovaikutuksessa solun kanssa.
Siitä hetkestä lähtien, kun virus tunkeutuu soluun, alkaa HIV-infektion vaihe – viruksen kantajatila, joka voi kestää 10 vuotta tai kauemmin; ja siitä hetkestä lähtien, kun virus aktivoituu, alkaa tauti – AIDS. Säätelygeeniensä ja niiden tuotteiden avulla virus alkaa lisääntyä aktiivisesti. TAT-proteiini voi lisätä viruksen lisääntymisnopeutta 1000-kertaisesti. Viruksen transkriptio on monimutkaista. Se sisältää sekä täyspitkän että subgenomisen mRNA:n muodostumisen, mRNA:n silmukoinnin ja sitten rakenne- ja säätelyproteiinien synteesin.
Rakenneproteiinien synteesi tapahtuu seuraavasti. Ensin syntetisoidaan Pr55Gag-esiastepolyproteiini (proteiini, jonka molekyylipaino on 55 kDa). Se sisältää neljä päädomeenia: matriisin (MA), kapsidin (CA), nukleokapsidin (NC) ja rb-domeenin, joista virusproteaasin katkaistessa Pr55Gag:n (se katkaistaan itse toisesta esiasteproteiinista, Gag-Pol:sta) muodostuvat rakenneproteiinit p17, p24, p7 ja rb. Pr55Gag-polyproteiinin muodostuminen on tärkein edellytys viruspartikkelien muodostumiselle. Juuri tämä proteiini määrittää virionin morfogeneesiohjelman. Se sisältää peräkkäin Gag-polyproteiinin kuljetuksen solukalvolle, vuorovaikutuksen sen kanssa ja proteiini-proteiini-vuorovaikutukset viruspartikkelin muodostumisen ja sen kuroutumisen aikana. Pr55Gag syntetisoidaan vapailla polyribosomeilla; proteiinimolekyylit kuljetetaan kalvolle, jossa ne ankkuroituvat hydrofobisiin alueisiinsa. CA-domeenilla on päärooli Gag-proteiinin natiivin konformaation luomisessa. NC-domeeni varmistaa ("sinkkisormiensa" avulla) kahden genomisen RNA:n molekyylin sisällyttämisen muodostuvan viruspartikkelin koostumukseen. Polyproteiinimolekyyli dimerisoituu aluksi matriisidomeenien vuorovaikutuksen seurauksena. Sitten dimeerit yhdistyvät heksameerisiksi (6 yksikön) komplekseiksi CA- ja NC-domeenien vuorovaikutuksen seurauksena. Lopuksi heksameerit muodostavat sivupinnoistaan yhdessä epäkypsiä pallomaisia virioneja, joiden sisällä genominen virus-RNA sijaitsee NC-domeenin vangitsemana.
Toinen esiasteproteiini, Prl60Gag-Pol (proteiini, jonka molekyylipaino on 160 kDa), syntetisoituu ribosomin kehyssiirron seurauksena gag-geenin 3'-pään translaation aikana alueella, joka sijaitsee välittömästi rb-proteiinia koodaavan alueen ylävirtaan. Tämä Gag-Pol-polyproteiini sisältää epätäydellisen Gag-proteiinisekvenssin (1-423 aminohappoa) ja Pol-sekvenssejä, jotka sisältävät PR-, RT- ja IN-domeenit. Gag-Pol-polyproteiinimolekyylejä syntetisoidaan myös vapailla polyribosomeilla ja ne kuljetetaan solukalvolle. Prl60Gagpol-polyproteiini sisältää kaikki Gag-polyproteiinille ominaiset molekyylien väliset vuorovaikutuskohdat ja kalvoon sitoutumiskohdat. Siksi Gag-Pol-polyproteiinimolekyylit fuusioituvat kalvoon ja Gag-molekyylien kanssa sisällytetään muodostuviin virioneihin, mikä johtaa aktiivisen proteaasin ilmestymiseen ja virionin kypsymisprosessin alkuun. HIV-1-proteaasi on erittäin aktiivinen vain dimeerin muodossa, joten sen itsensä irtoamiseksi Prl60Gag-Pol-molekyylistä tarvitaan näiden molekyylien dimeroitumista. Virionin kypsyminen koostuu siitä, että vapautunut aktiivinen proteaasi leikkaa prl60Gag-Pol- ja Gag55-molekyylit niiden tunnistamista kohdista; muodostuu proteiineja p17, p24, p7, p6, revertaasi ja integraasi, jotka liittyvät virusrakenteeseen.
Env-proteiini syntetisoidaan endoplasmisen retikulumin kalvoihin liittyvissä ribosomeissa, minkä jälkeen se glykosyloituu, solun proteaasi pilkkoo sen gp120:ksi ja gp41:ksi ja kuljetetaan solun pinnalle. Tässä tapauksessa gp41 tunkeutuu kalvon läpi ja sitoutuu kalvon sisäpintaan liittyvän Gag-proteiinimolekyylin matriisidomeeneihin. Tämä yhteys säilyy kypsässä virionissa.
Viruspartikkelien kokoaminen koostuu siis esiasteproteiinien ja niihin liittyvien RNA-molekyylien aggregaatiosta isäntäsolun solukalvolla, epäkypsien virionien muodostumisesta ja niiden vapautumisesta silmumisen kautta solun pinnalta. Silmumisen aikana virioni ympäröi itsensä solukalvolla, johon gp41- ja gp120-molekyylit uppoutuvat. Silmumisen aikana tai mahdollisesti virionien vapautumisen jälkeen tapahtuu niiden kypsyminen, joka suoritetaan virusproteaasin avulla ja koostuu esiasteproteiinien Pr55Gag ja Prl60Gag-Pol proteolyyttisestä pilkkomisesta kypsän viruksen proteiineiksi ja niiden yhdistymisestä tiettyihin rakennekomplekseihin. Viruksen morfogeneesin prosesseissa johtava rooli on esiastepolyproteiinilla Pr55Gag, joka organisoi ja kokoaa epäkypsän virionin; sen kypsymisprosessin viimeistelee spesifinen virusproteaasi.
Immuunipuutoksen syyt
Yksi HIV-infektion immuunipuutoksen pääasiallisista syistä on T-auttajasolujen massakuolema. Se tapahtuu seuraavien tapahtumien seurauksena. Ensinnäkin viruksella infektoidut T-auttajasolut kuolevat apoptoosin vuoksi. AIDS-potilailla viruksen replikaation, apoptoosin ja T-auttajasolujen määrän vähenemisen uskotaan olevan yhteydessä toisiinsa. Toiseksi T-tappajat tunnistavat ja tuhoavat viruksella infektoituneet tai adsorboitunutta gpl20-molekyyliä kantavat T-solut, sekä viruksen infektoimat ja ei-viruksen infektoimat T-auttajasolut, jotka muodostavat symplasteja (synsytium), jotka koostuvat useista kymmenistä soluista (jotkut niistä kuolevat virusten lisääntymisen seurauksena niissä). Suuren määrän T-auttajasolujen tuhoutumisen seurauksena B-lymfosyyttien kalvoreseptorien ilmentyminen interleukiini-2:lle vähenee, erilaisten interleukiinien (B-lymfosyyttien kasvutekijät ja erilaistuminen - IL-4, IL-5, IL-6 jne.) synteesi häiriintyy, mikä johtaa T-tappajajärjestelmän toiminnan häiriintymiseen. Komplementin ja makrofagien järjestelmien toiminta heikkenee. Viruksella infektoidut makrofagit ja monosyytit eivät kuole pitkään aikaan, mutta ne eivät pysty poistamaan virusta elimistöstä. Lopuksi, koska gpl20 on rakenteellisesti ja antigeenisesti samankaltaista joidenkin kehon epiteelisolujen reseptorien kanssa (mukaan lukien HIV:n elinsiirtotartuntaa välittävät trofoblastireseptorit), syntetisoidaan laaja-alaisia antireseptorivasta-aineita. Tällaiset vasta-aineet kykenevät estämään erilaisia solureseptoreita ja vaikeuttamaan taudin kulkua autoimmuunisairauksissa. HIV-infektion seurauksena on kaikkien immuunijärjestelmän päälinkkien häviäminen. Tällaiset potilaat tulevat puolustuskyvyttömiksi monenlaisia mikro-organismeja vastaan. Tämä johtaa opportunististen infektioiden ja kasvainten kehittymiseen. HIV-infektiota sairastavilla potilailla on lisääntynyt riski sairastua ainakin kolmeen syöpätyyppiin: Kaposin sarkooma; karsinooma (mukaan lukien ihosyöpä); B-solulymfooma, joka johtuu B-lymfosyyttien pahanlaatuisesta muutoksesta. HIV ei kuitenkaan ole ainoastaan lymfosytotrooppinen, vaan myös neurotrooppinen. Se tunkeutuu keskushermoston soluihin (astrosyytteihin) sekä reseptorivälitteisen endosytoosin että astrosyyttien suorittaman virustartunnan saaneiden lymfoblastien fagosytoosin kautta. Kun virus on vuorovaikutuksessa astrosyyttien kanssa, muodostuu myös symplasteja, jotka helpottavat taudinaiheuttajan leviämistä solujen välisten kanavien kautta. Virus voi säilyä makrofageissa ja monosyyteissä pitkään, joten ne toimivat sen säiliönä ja jakelijana kehossa ja pystyvät tunkeutumaan kaikkiin kudoksiin. Tartunnan saaneilla makrofageilla on merkittävä rooli HIV:n kulkeutumisessa keskushermostoon ja sen vaurioissa. 10 %:lla potilaista primaariset kliiniset oireyhtymät liittyvät keskushermoston vaurioihin ja ilmenevät dementiana. HIV-tartunnan saaneille ihmisille on siis ominaista kolme sairausryhmää: opportunistiset infektiot,kasvainsairaudet ja keskushermoston vauriot.
HIV-infektion epidemiologia
HIV-infektion lähde on vain ihminen - sairastunut tai viruksen kantaja. Ihmisen immuunikatovirusta (HIV) on veressä, siittiöissä ja kohdunkaulan nesteessä; imettävillä äideillä rintamaidossa. Tartunta tapahtuu sukupuoliteitse, veren ja sen valmisteiden välityksellä sekä äidiltä lapselle ennen synnytystä, synnytyksen aikana ja sen jälkeen. Viruksen tartuntatapauksia ruoan, juomien ja hyönteisten puremien kautta ei tunneta.
Huumeriippuvuus edistää aidsin leviämistä. HIV:n ilmaantuvuus kasvaa joka vuosi. WHO:n mukaan vuosina 1980–2000 58 miljoonaa ihmistä oli saanut HIV-tartunnan. Pelkästään vuonna 2000 tartunnan sai maailmanlaajuisesti 5,3 miljoonaa ihmistä, ja aidsiin kuoli 3 miljoonaa ihmistä. Venäjällä oli 1. tammikuuta 2004 mennessä rekisteröity 264 tuhatta HIV-tartunnan saanutta. Puolet HIV-tartunnan saaneista kuolee 11–12 vuoden kuluessa tartunnasta. Vuoden 2004 alussa noin 180:lla Venäjän 100 000 kansalaisesta oli diagnosoitu "HIV-infektio". Ennusteiden mukaan tällä sairastuvuuden tasolla HIV-tartunnan saaneiden kokonaismäärä Venäjällä on vuoteen 2012 mennessä 2,5–3 miljoonaa ihmistä. HIV-infektion torjunnan monimutkaisuus riippuu useista syistä: ensinnäkin ei ole tehokkaita hoito- ja ehkäisymenetelmiä; toiseksi HIV-infektion itämisaika voi olla yli 10 vuotta. Sen kesto riippuu T-lymfosyytin ja sen kromosomissa olevan DNA-proviruksen aktivaatiohetkestä. On edelleen epäselvää, ovatko kaikki viruksen saaneet tuomittuja AIDSiin vai onko viruksen pitkäaikainen kantaminen ilman sairautta mahdollista (mikä vaikuttaa epätodennäköiseltä). Lopuksi on olemassa useita ihmisen immuunikatoviruksia (HIV-1, HIV-2), joiden antigeeniset erot estävät ristiimmuniteetin muodostumisen. Apinan immuunikatoviruksen (SIV) löytäminen valaisi HIV:n alkuperää. SIV on genomirakenteeltaan samanlainen kuin HIV, mutta nukleotidisekvenssiltään se eroaa merkittävästi. HIV-2 on serologisilta ominaisuuksiltaan HIV-1:n ja SIV:n välimaastossa ja nukleotidisekvenssiltään lähempänä SIV:tä. Tässä suhteessa V. M. Zhdanov ehdotti, että HIV-1-, HIV-2- ja SIV-virukset ovat peräisin yhteisestä esi-isästä. R. Gallon mukaan on mahdollista, että jokin SIV-viruksista on jotenkin päässyt ihmiskehoon, jossa se on käynyt läpi useita mutaatioita, jotka ovat johtaneet HIV-1:n, HIV-2:n ja sen muiden muotojen syntymiseen.
HIV-infektion oireet
Ihmisen immuunikatoviruksella on joitakin piirteitä, jotka pitkälti määräävät taudin patogeneesin. Viruksella on erittäin korkea lisääntymisnopeus, joka määräytyy sen säätelyelementtien perusteella (aktiivisessa vaiheessa jopa 5 000 virionia syntetisoidaan 5 minuutissa). Fuusioproteiinin (gp41) läsnäolon vuoksi virus indusoi laajojen synkytiaalirakenteiden muodostumisen infektoituneiden ja infektoitumattomien T-auttajasolujen fuusion seurauksena, mikä johtaa niiden massakuolemaan. Suurina määrinä muodostuneet gpl20-proteiinimolekyylit kiertävät vapaasti veressä ja sitoutuvat infektoitumattomien T-auttajasolujen reseptoreihin, minkä seurauksena T-tappajat tunnistavat ja tuhoavat ne. Virus voi levitä solujen välisiä kanavia pitkin solusta toiseen, jolloin vasta-aineet eivät pääse siitä helposti eroon.
HIV-infektion kliiniset kriteerit
Aikuisilla HIV-infektio diagnosoidaan, kun heillä on vähintään kaksi vakavaa oiretta yhdessä vähintään yhden lievän oireen kanssa ja muita tunnettuja immuunipuutoksen syitä (syöpä, synnynnäinen immuunipuutos, vaikea nälkiintyminen jne.) ei ole. Vakavia oireita ovat:
- painonpudotus 10% tai enemmän;
- pitkittynyt kuumeinen tila, ajoittainen tai jatkuva;
- krooninen ripuli.
Lieviä oireita: pitkittynyt yskä, yleistynyt ihottuma, toistuva vyöruusu, suun ja nielun kandidiaasi, krooninen herpes simplex, yleistynyt lymfadenopatia. AIDS-diagnoosi tehdään, jos potilaalla on vain Kaposin sarkooma, kryptokokkimeningiiitti tai pneumokystis-keuhkokuume. Taudin kliiniseen kuvaan vaikuttaa samanaikainen opportunistinen infektio.
Ihmisen immuunikatoviruksen (HIV) viljelymenetelmät
HIV-1:tä ja HIV-2:ta voidaan viljellä vain yhden TCV4-lymfosyyttikloonin - H9:n - soluissa, joka on saatu leukeemisista TCV4-lymfosyyteistä. Näihin tarkoituksiin voidaan käyttää myös astrosyyttisolujen yksikerroksisia viljelmiä, joissa HIV-1 lisääntyy hyvin. Simpanssit ovat alttiita HIV-1:lle eläinten keskuudessa.
Viruksen vastustuskyky ulkoympäristössä on heikko. Se kuolee auringonvalon ja UV-säteilyn vaikutuksesta, tuhoutuu 80 °C:ssa 30 minuutissa ja yleisesti käytetyillä desinfiointiaineilla käsiteltäessä 20–30 minuutissa. Virusta sisältävän materiaalin desinfiointiin on käytettävä mykobakteereja tappavia desinfiointiaineita, koska ne ovat tehokkaita vastustuskykyisimpiä mikro-organismeja vastaan.
HIV-infektion laboratoriodiagnostiikka
Tärkein menetelmä viruksen kantajuuden ja HIV-infektion diagnosoimiseksi on entsyymi-immunomääritys. Koska gpl20:lla on kuitenkin rakenteellista ja antigeenistä samankaltaisuutta joidenkin ihmissolujen reseptoreiden kanssa, mukaan lukien reseptorit, jotka kuljettavat immunoglobuliineja limakalvojen epiteelisolujen läpi, elimistössä voi esiintyä gpl20:ta vastaan suunnattuja vasta-aineita. Tässä tapauksessa voi olla vääriä positiivisia ELISA-tuloksia. Siksi kaikki positiivisesti reagoivat seeruminäytteet tutkittavilta tehdään lisäanalyysi immunoblottausmenetelmällä eli Western blot -menetelmällä. Tämä menetelmä perustuu tutkittavien vasta-aineiden tunnistamiseen niiden elektroforeettisen erottelun ja sitä seuraavan testauksen jälkeen leimatuilla lajivasta-aineilla. Virologista menetelmää käytetään harvoin viruksen viljelyn monimutkaisuuden vuoksi. H9-lymfosyyttikloonia käytetään virusantigeenien - diagnostisten testijärjestelmien välttämättömien komponenttien - hankkimiseen. CPR-menetelmä mahdollistaa viruksen havaitsemisen viremian varhaisessa vaiheessa.
HIV-infektion hoito
On tarpeen löytää tai syntetisoida lääkkeitä, jotka tehokkaasti tukahduttavat käänteiskopioijaentsyymin (revertaasin) tai virusproteaasin aktiivisuuden. Ne estäisivät DNA-proviruksen muodostumisen ja (tai) estäisivät viruksen solunsisäisen lisääntymisen. Nykyaikainen HIV-tartunnan saaneiden potilaiden hoitostrategia perustuu periaatteeseen, jossa käytetään yhdistettyjä lääkkeitä, jotka estävät virusproteaasia (toinen lääkkeistä) ja käänteistä eroosia (kaksi eri lääkettä) - yhdistettyä (kolmois)hoitoa. Venäjällä HIV-tartunnan saaneiden potilaiden hoitoon suositellaan kahden kotimaisen lääkkeen yhdistelmäkäyttöä: fosfatsidia ja kriksivania, jotka spesifisesti tukahduttavat HIV:n lisääntymistä lisääntymisen varhaisessa ja myöhäisessä vaiheessa, erityisesti atsidotymidiinin vähentyneen aktiivisuuden yhteydessä.
Spesifisen profylaksin ongelmana on tarve luoda rokote, joka varmistaisi tehokkaan soluvälitteisen immuniteetin muodostumisen virusspesifisten sytotoksisten lymfosyyttien perusteella ilman merkittävää vasta-aineiden tuotantoa. Tällaisen immuniteetin tarjoavat Thl-auttajat. On mahdollista, että vasta-aineet, mukaan lukien virusta neutraloivat, eivät ole ainoastaan tehottomia HIV-infektion tukahduttamisessa, vaan ne tukahduttavat korkealla tasolla soluvälitteisen immuniteetin. Siksi HIV-rokotteen on ensinnäkin täytettävä kaksi päävaatimusta: a) oltava ehdottoman turvallinen ja b) stimuloitava T-sytotoksisten lymfosyyttien aktiivisuutta. Tutkitaan tapetuista (inaktivoiduista) viruksista ja yksittäisistä antigeeneistä, joilla on korkeat suojaavat ominaisuudet, saatujen erilaisten rokotevarianttien tehokkuutta. Tällaiset antigeenit voidaan joko eristää itse virioneista tai syntetisoida kemiallisesti. Geenitekniikan menetelmiin perustuvaa rokotetta on ehdotettu. Se on rekombinantti vacciniavirus, joka kantaa HIV-geenejä, jotka vastaavat voimakkaiden immunogeenisten ominaisuuksien omaavien antigeenien synteesistä. Näiden rokotteiden tehokkuuden kysymys vaatii huomattavasti aikaa HIV-infektion pitkän itämisajan ja patogeenin suuren vaihtelevuuden vuoksi. Erittäin tehokkaan HIV-rokotteen luominen on kiireellinen perustavanlaatuinen ongelma.

