
Kaikki iLive-sisältö tarkistetaan lääketieteellisesti tai se tarkistetaan tosiasiallisen tarkkuuden varmistamiseksi.
Meillä on tiukat hankintaohjeet ja vain linkki hyvämaineisiin mediasivustoihin, akateemisiin tutkimuslaitoksiin ja mahdollisuuksien mukaan lääketieteellisesti vertaisarvioituihin tutkimuksiin. Huomaa, että suluissa ([1], [2] jne.) Olevat numerot ovat napsautettavia linkkejä näihin tutkimuksiin.
Jos sinusta tuntuu, että jokin sisältö on virheellinen, vanhentunut tai muuten kyseenalainen, valitse se ja paina Ctrl + Enter.
Uudet havainnot auttavat ymmärtämään paremmin Rettin oireyhtymän syitä.
Viimeksi tarkistettu: 02.07.2025

Rettin oireyhtymä on harvinainen neurologinen kehityshäiriö, johon ei tällä hetkellä ole parannuskeinoa tai hyvää hoitoa. Se aiheuttaa vakavia fyysisiä ja kognitiivisia oireita, joista monet ovat päällekkäisiä autismin kirjon häiriöiden kanssa.
Rettin oireyhtymän aiheuttavat MECP2-geenin mutaatiot. Geeniä ilmentyy runsaasti aivoissa ja sillä näyttää olevan tärkeä rooli hermosolujen terveyden ylläpitämisessä. Geeni sijaitsee X-kromosomissa, ja oireyhtymä vaikuttaa pääasiassa tyttöihin. Rettin oireyhtymän hoitojen kehittämiseksi tutkijat haluavat ymmärtää paremmin MECP2:ta ja sen toimintoja aivoissa.
Tutkijat, mukaan lukien Whitehead-instituutin perustajajäsen Rudolf Jaenisch, ovat tutkineet MECP2-geeniä vuosikymmeniä, mutta monet geenin perustiedot ovat edelleen tuntemattomia. Geenin koodaama proteiini, MECP2, osallistuu geenien säätelyyn; se sitoutuu DNA:han ja vaikuttaa useiden muiden geenien ilmentymistasoihin eli niiden tuottaman proteiinin määrään.
Tutkijoilla ei kuitenkaan ollut täydellistä luetteloa MECP2:n vaikuttamista geeneistä, eikä siitä, miten MECP2 vaikuttaa näihin geeneihin, ollut yksimielisyyttä.
MECP2:n varhaiset tutkimukset viittasivat siihen, että se oli repressori, joka vähensi kohdegeenien ilmentymistä, mutta Jaenischin ja muiden tutkimukset olivat aiemmin osoittaneet, että MECP2 toimii myös aktivaattorina, joka lisää kohteidensa ilmentymistä – ja että se saattaa olla alun perin aktivaattori. Myöskään MECP2:n vaikutusmekanismi tai se, mitä proteiini tarkalleen ottaen tekee aiheuttaakseen muutoksia geenien ilmentymisessä, ei ollut tiedossa.
Teknologian rajoitukset ovat estäneet tutkijoita saamasta selvyyttä näihin kysymyksiin. Mutta Yanish, hänen laboratorionsa postdoc Yi Liu ja Yanishin entinen laboratorion jäsen Anthony Flamier, joka on nyt apulaisprofessori CHU Sainte-Justine -tutkimuskeskuksessa Montréalin yliopistossa, ovat käyttäneet huipputekniikoita vastatakseen näihin jäljellä oleviin MECP2:ta koskeviin kysymyksiin ja saadakseen uusia näkemyksiä sen roolista aivojen terveydessä ja sairauksissa.
Heidän tuloksensa julkaistiin Neuron-lehdessä, ja tutkijat loivat myös MECP2-datalleen verkkoarkiston, MECP2-NeuroAtlas-portaalin, resurssiksi muille tutkijoille.
"Uskon, että tämä tutkimus muuttaa perustavanlaatuisesti ihmisten ymmärrystä siitä, miten MECP2 aiheuttaa Rettin oireyhtymää. Meillä on täysin uusi ymmärrys mekanismista, ja se voi tarjota uusia mahdollisuuksia taudin hoitojen kehittämiseen", sanoo Janisch, joka on myös biologian professori MIT:ssä.
MECP2:n syvällisempi ymmärtäminen aivoissa
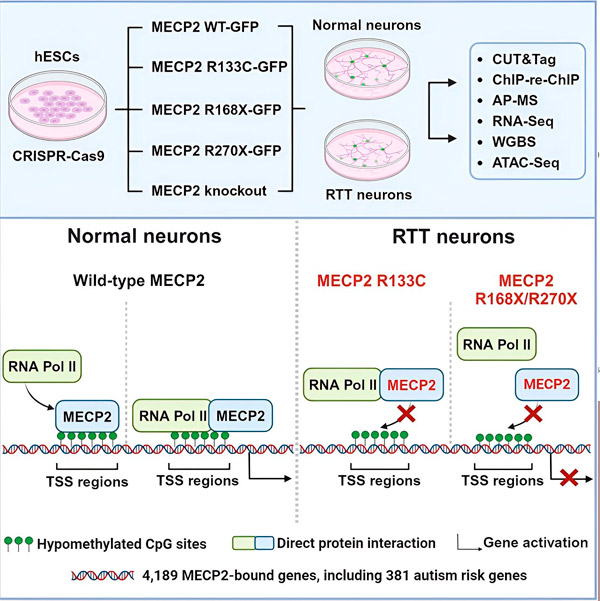
Tutkijat loivat ensin yksityiskohtaisen kartan siitä, mihin MECP2 sitoutuu ihmisen hermosolujen geenisekvensseissä, joko geenien sisällä tai niiden lähellä olevilla DNA:n säätelyalueilla. He käyttivät CUT&Tag-nimistä lähestymistapaa, joka pystyy paikantamaan proteiinien vuorovaikutukset DNA:n kanssa suurella tarkkuudella.
Tutkijat löysivät yli 4 000 MECP2:een liittyvää geeniä. He toistivat kartoituksensa hermosoluissa, joissa oli yleisiä Rettin oireyhtymään liittyviä MECP2-mutaatioita, selvittääkseen, missä MECP2 on ehtynyt tautitilassa.
MECP2:n sitoutumisgeenien tunteminen mahdollisti Liulle ja Flamierille yhteyksien löytämisen MECP2:n kohteiden ja aivojen terveyden välillä. He havaitsivat, että monet sen kohteista osallistuvat hermosolujen aksonien ja synapsien kehitykseen ja toimintaan.
He vertasivat myös MECP2-kohteiden luetteloaan Simons Foundation Autism Research Initiativen (SFARI) autismiin liittyvien geenien tietokantaan ja havaitsivat, että 381 geeniä kyseisessä tietokannassa on MECP2-kohteita.
Lähde: Neuron (2024). DOI: 10.1016/j.neuron.2024.04.007
Nämä löydökset voivat auttaa selventämään Rettin oireyhtymän autismioireiden taustalla olevia mekanismeja ja tarjota hyvän lähtökohdan MECP2:n mahdollisen roolin tutkimiselle autismissa.
"Olemme luoneet ensimmäisen integroidun kartan MECP2-epigenomista terveydessä ja sairauksissa, ja tämä kartta voi ohjata tulevaa tutkimusta", Liu sanoo. "Tieto siitä, mitkä geenit ovat MECP2:n kohteita ja mitkä geenit häiriintyvät suoraan sairaudessa, tarjoaa vankan pohjan Rettin oireyhtymän ymmärtämiselle ja neuronien geenisäätelyä koskevien kysymysten esittämiselle."
Tutkijat tarkastelivat myös, lisäsikö vai vähensikö MECP2 kohdegeenien ilmentymistä. Liu ja Flamier löysivät esimerkkejä, joissa MECP2:lla oli molempia rooleja, koska jotkut ovat aiemmin tunnistaneet MECP2:n aktivaattoriksi ja toiset repressoriksi.
Vaikka MECP2:ta pidetään useammin repressorina, Liu ja Flamier havaitsivat sen olevan enimmäkseen aktivaattori – mikä vahvistaa Jaenischin ja Liun aiempia havaintoja. Yhdessä uudessa kokeessa osoitettiin, että MECP2 aktivoi vähintään 80 % kohteistaan, ja toisessa havaittiin, että se aktivoi jopa 88 % kohteistaan.
Tutkijoiden luoma kohdegeenikartta antoi lisätietoa MECP2:n roolista aktivaattorina. He havaitsivat, että MECP2:n aktivoimissa geeneissä se tyypillisesti sitoutuu transkription aloituskohdaksi kutsuttuun DNA-alueeseen geenin ylävirtaan.
Tämä on kohta, jossa solun koneisto aloittaa geenin transkription RNA:ksi, minkä jälkeen RNA transloidaan toiminnalliseksi proteiiniksi, joka on geenien ilmentymisen tuote. MECP2:n läsnäolo transkription aloituskohdassa, josta geenien ilmentyminen alkaa, on yhdenmukainen sen roolin kanssa geenien aktivaattorina.
Tutkijat alkoivat sitten selvittää MECP2:n roolia geenien aktivoinnissa. He tarkastelivat, mihin molekyyleihin MECP2 sitoutuu tässä kohdassa DNA:n lisäksi, ja havaitsivat, että MECP2 on suorassa vuorovaikutuksessa RNA-polymeraasi II:n (RNA Pol II) kanssa. RNA Pol II on keskeinen solukone, joka transkriptoi DNA:ta RNA:ksi. RNA Pol II ei löydä geenejä yksinään, joten se tarvitsee useita kofaktoreita eli proteiiniyhteistyökumppaneita auttaakseen sitä suorittamaan työnsä.
Tutkijat ehdottavat, että MECP2 toimii yhtenä tällaisena kofaktorina, joka auttaa RNA-polymeraasi II:ta aloittamaan transkription geeneissä, joihin MECP2 sitoutuu. MECP2:n rakenneanalyysi on tunnistanut molekyylin osia, jotka sitoutuvat RNA-polymeraasi II:een, ja muut kokeet ovat vahvistaneet, että MECP2:n menetys vähentää RNA-polymeraasi II:n läsnäoloa sopivissa transkription aloituskohdissa sekä kohdegeenien ilmentymistasoja.
Tämä viittaa siihen, että Rettin oireyhtymä voi johtua MECP2:n kohdentamien geenien transkription vähenemisestä MECP2-mutaatioiden vuoksi, jotka estävät sitä sitoutumasta RNA-polymeraasi II:een tai DNA:han. Tämän ajatuksen mukaisesti yleisimmät sairauksiin liittyvät MECP2-mutaatiot ovat katkaisuja: mutaatioita, joissa osa proteiinista puuttuu, mikä voi muuttaa MECP2:n ja RNA-polymeraasi II:n välistä vuorovaikutusta.
Tutkijat toivovat, että heidän löydöksensä eivät ainoastaan muuta ymmärrystämme MECP2:sta, vaan että syvempi ja laajempi ymmärrys siitä, miten MECP2 vaikuttaa aivojen kehitykseen ja toimintaan, voisi johtaa uusiin näkemyksiin, jotka auttavat Rettin oireyhtymää ja siihen liittyviä häiriöitä, kuten autismia, sairastavia ihmisiä.
"Tämä projekti on loistava esimerkki Janischin laboratorion yhteistyöhön perustuvasta luonteesta", Flamier sanoo. "Rudolfilla ja minulla oli erityinen Rettin oireyhtymään liittyvä ongelma, ja minulla oli kokemusta CUT&Tag-teknologiasta, joka voisi ratkaista ongelman. Keskustelun kautta ymmärsimme, että voisimme yhdistää voimamme, ja nyt meillä on loistava tietopankki MECP2:sta ja sen yhteyksistä sairauksiin."
